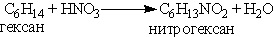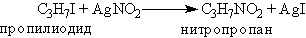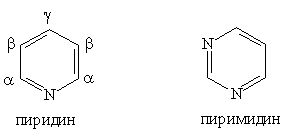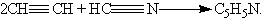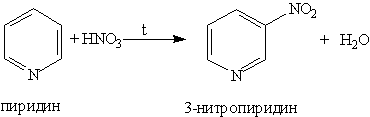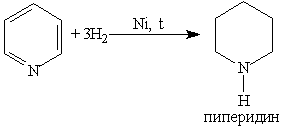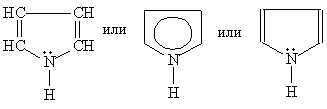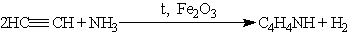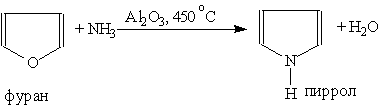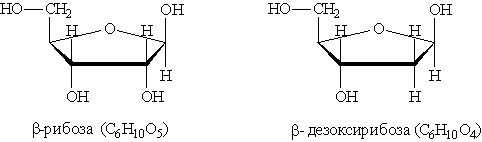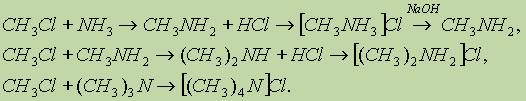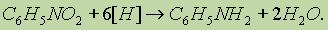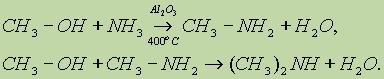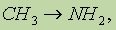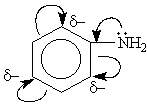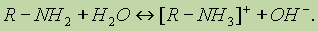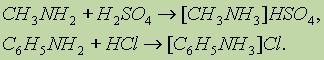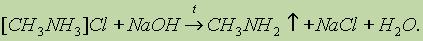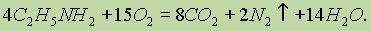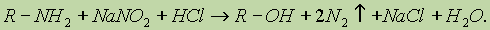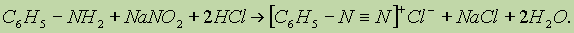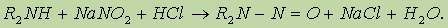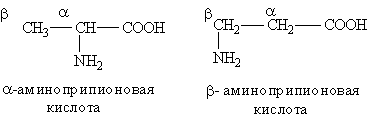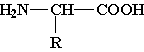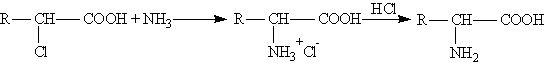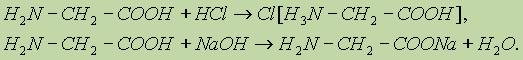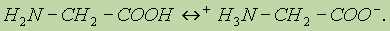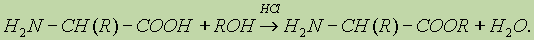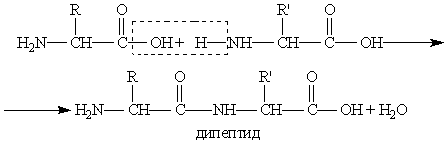აბაშის ხმა
Каталог статей
| მთავარი » სტატიები » Химия » Химия |
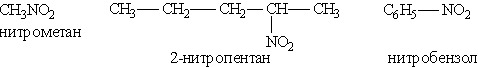
Азотсодержащие органические соединенияНитросоединения. Нитросоединениями называются органические вещества, в молекулах которых содержится нитрогруппа — NO2 при атоме углерода. Их можно рассматривать как производные углеводородов, получающиеся путем замещения атома водорода Названия нитросоединемий производят от названий исходных углеводородов с добавлением приставки нитро-:
Общая формула этих соединений R—NO2. Введение в органическое вещество нитрогруппы называется нитрованием. Его можно проводить разными способами. Нитрование
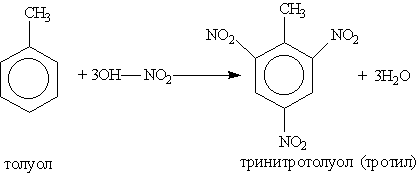
Тринитротолуол хорошо известен как взрывчатое вещество. Взрывается только от детонации. Горит коптящим пламенем без взрыва. Нитрование предельных углеводородов
Нитросоединения часто также получают взаимодействием алкил-галогенидов с нитритом серебра:
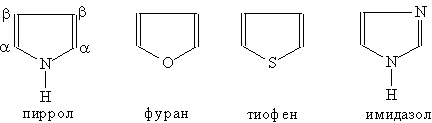
При восстановлении нитросоединений образуются амины. Азотсодержащие гетероциклические соединения. Гетероциклические Атомы других элементов, входящие в состав гетероцикла, называются гетероатомами. Наиболее часто встречаются в составе гетероциклов гетероатомы азота, кислорода, серы, хотя могут существовать гетероциклические соединения с самыми различными элементами, имеющими валентность не менее двух. Гетероциклические соединения могут иметь в цикле 3, 4, 5, 6 и более атомов. Однако наибольшее значение имеют пяти- и шестичленные гетероциклы. Во многих гетероциклических соединениях электронное строение связей в кольце такое же, как и в Для гетероциклов обычно пользуются эмпирическими названиями. Пятичленные гетероциклы
Шестичленные гетероциклы
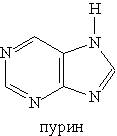
Большое значение имеют гетероциклы, конденсированные с бензольным кольцом или с другим гетероциклом, например пурин:
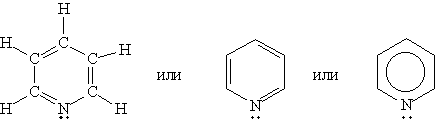
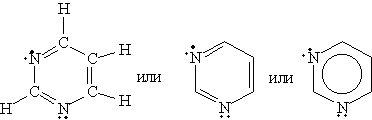
Шестичленные гетероциклы. Пиридин C5H5N
жидкость, немного легче воды, с характерным неприятным запахом; с водой смешивается в любых отношениях. Пиридин и его гомологи выделяют из каменноугольной смолы. В лабораторных условиях пиридин можно синтезировать из синильной кислоты и ацетилена:
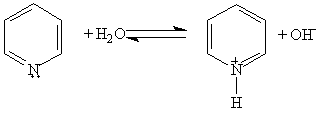
Химические свойства пиридина определяются наличием ароматической системы, содержащей шесть p -электронов, и атома азота с неподеленной электронной парой. 1. Основные свойства. Пиридин — более слабое основание, чем алифатические амины. Его водный раствор окрашивает лакмус в синий цвет:
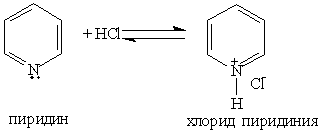
При взаимодействии пиридина с сильными кислотами образуются соли пиридиния:
2. Ароматические свойства. Подобно бензолу, пиридин вступает в реакции электрофильного замещения,
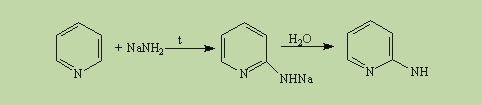
Атом азота в реакциях электрофильного замещения ведет себя как заместитель 2-го рода, поэтому электрофильное замещение происходит в мета-положение. В отличие от бензола пиридин способен вступать в реакции нуклеофильного замещения, поскольку атом азота оттягивает на себя электронную плотность из ароматической системы и орто-пара-положения по отношению к атому азота обеднены электронами. Так, пиридин может реагировать с амидом натрия, образуя смесь орто- и пара-аминопиридинов (реакция Чичибабина):
При гидрировании пиридина ароматическая система разрушается и образуется пиперидин, который представляет собой циклический вторичный амин и является гораздо более сильным основанием, чем пиридин:
Пиримидин C4H4N2 — шестичленный гетероцикл с двумя атомами азота. Его можно
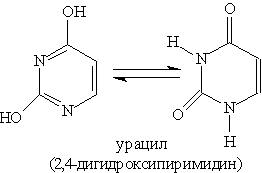
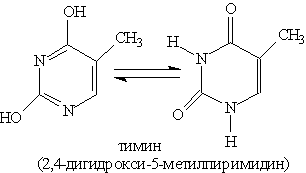
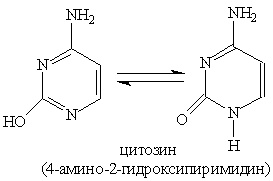
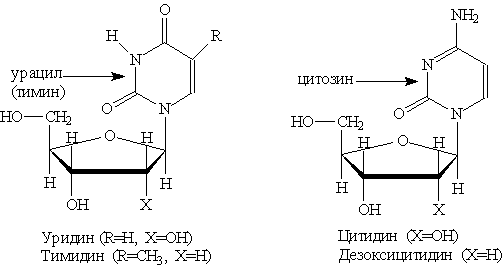
Благодаря наличию в кольце двух электроотрицательных атомов азота пиримидин еще Основное значение пиримидина состоит в том, что он является родоначальником класса пиримидиновых оснований. Пиримидиновые основания — производные пиримидина, остатки которых входят в состав нуклеиновых кислот: урацил, тимин, цитозин.
Каждое из этих оснований может существовать в двух формах. В свободном состоянии основания существуют в ароматической форме, а в состав нуклеиновых кислот они входят в NH-форме. Соединения с пятичленным циклом. Пиррол C4H4NH - пятичленныи гетероцикл с одним атомом азота.
Ароматическая система содержит шесть p -электронов (по одному от четырех атомов углерода и пара электронов атома азота). В отличие от пиридина электронная пара атома азота в Пиррол — бесцветная жидкость с запахом, напоминающим запах Пиррол получают конденсацией ацетилена с аммиаком:
или аммонолизом пятичленных циклов с другими гетероатомами (реакция Юрьева):
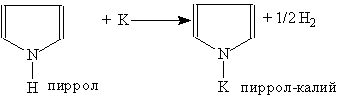
Сильные минеральные кислоты могут вытягивать электронную пару атома азота из ароматической Пиррол проявляет свойства очень слабой кислоты. Он реагирует с калием, образуя пиррол-калий:
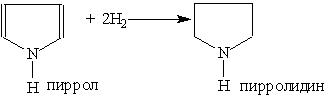
Пиррол, как ароматическое соединение, склонен к реакциям электрофильного замещения, которые протекают преимущественно у a -атома углерода (соседнего с атомом азота). При гидрировании пиррола образуется пирролидин — циклический вторичный амин, проявляющий основные свойства:
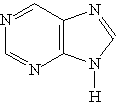
Пурин — гетероцикл, включающий два сочлененных цикла: пиридиновый и имидазольный:
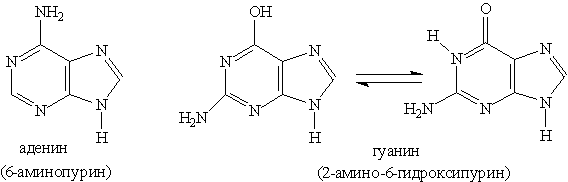
Ароматическая система пурина включает десять p -электронов (восемь электронов двойных связей и два электрона пиррольного атома азота). Пурин — амфотерное соединение. Слабые Основное значение пурина состоит в том, что он является родоначальником класса пуриновых оснований. Пуриновые основания — производные пурина, остатки которых входят в состав нуклеиновых кислот: аденин, гуанин.
Нуклеиновые кислоты. Нуклеиновые Строение нуклеиновых кислот можно установить, анализируя продукты их гидролиза.
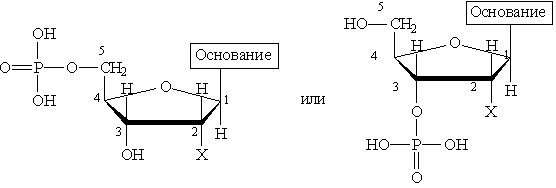
При частичном гидролизе нуклеиновых кислот образуется смесь нуклеотидов,
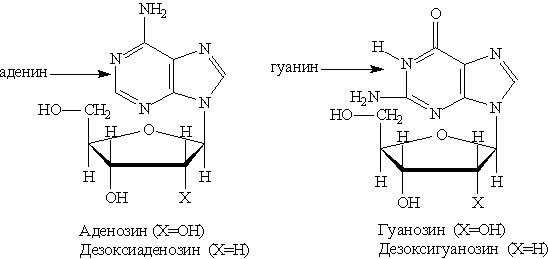
где Х = ОН для рибонуклеотидов, построенных на основе рибозы, и Х==Н для дезоксирибонуклеотидов, построенных на основе дезоксирибозы. В зависимости от типа азотистого основания различают пуриновые и пиримидиновые нуклеотиды. Нуклеотид — основная структурная единица нуклеиновых кислот, их мономерное звено. Нуклеиновые кислоты, состоящие из рибонуклеотидов, называют рибонуклеиновыми кислотами (РНК). Нуклеиновые кислоты, состоящие из дезоксирибонуклеотидов, называют дезоксирибонуклеиновыми кислотами (ДНК). В состав молекул РНК входят нуклеотиды, содержащие основания аденин, гуанин, цитозин и урацил. В состав молекул ДНК входят нуклеотиды, содержащие аденин, гуанин, цитозин и тимин. Для обозначения оснований используют однобуквенные сокращения: аденин — А, гуанин — G, тимин — Т, цитозин — С, урацил — U. Свойства ДНК и РНК определяются последовательностью оснований в При частичном гидролизе нуклеотидов отщепляется остаток фосфорной кислоты и образуются нуклеозиды, молекулы которых состоят из остатка пуринового или пиримидинового основания, Пуриновые нуклеозиды:
Пиримидиновые нуклеозиды:
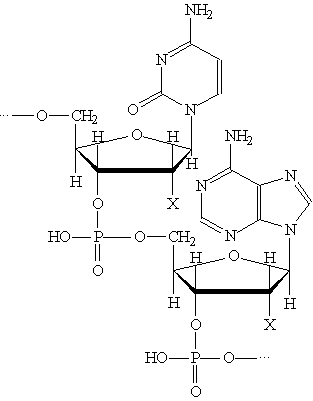
В молекулах ДНК и РНК отдельные
Пространственная структура полинуклеотидных цепей ДНК и Таким образом, две спирали в молекуле ДНК комплементарны друг другу. В каждой паре оснований, связанных водородными связями, одно из Длина полинуклеотидных цепей ДНК практически неограниченна. Число пар В отличие от ДНК молекулы РНК состоят из одной полинуклеотидной цепи. Биологическая роль нуклеиновых кислот. ДНК содержит всю генетическую информацию, но непосредственно в синтезе белков не участвует. Роль посредника между ДНК и местом синтеза белка выполняет РНК. Процесс синтеза белка на основе генетической информации схематично можно разбить на две основные стадии: считывание информации (транскрипция) и синтез белка (трансляция). Клетки содержат три типа РНК, которые выполняют различные функции. 1. Информационная, или матричная. РНК 2. Транспортная РНК 3. Рибосомная РНК (рРНК) непосредственно участвует в синтезе белков в рибосомах. Рибосомы — это сложные надмолекулярные структуры, которые состоят из четырех рРНК и нескольких десятков белков. Фактически рибосомы — это фабрики по производству белков. Все виды РНК синтезируются на двойной спирали ДНК. Последовательность оснований в мРНК — это генетический код, Амины. Амины — органические соединения, которые можно В зависимости от природы радикала амины могут быть Четвертичные аммониевые соли типа [R4N]+Cl- — это органические аналоги неорганических аммониевых солей. Названия первичных аминов обычно производят от названий соответствующих углеводородов, добавляя к ним приставку амино- или окончание -амин. Названия вторичных и третичных аминов чаще всего образуют по принципам рациональной номенклатуры, перечисляя имеющиеся в соединении радикалы: первичные R—NH2: СН3—NH2 — метиламин; С6Н5—NH2 — фениламин; вторичные R—NH—R': (CH2)NH — диметиламин; С6Н5—NH—СН3 —метилфениламин; третичные R—N(R')—R": (СН3)3Н — триметиламин; (C6H5)3N — трифениламин. Получение. 1. Нагревание алкилгалогенидов с
2. Ароматические амины получают восстановлением нитросоединений:
Для восстановления можно использовать цинк или железо в кислой среде или алюминий в щелочной среде. 3. Низшие амины получают, пропуская смесь спирта и аммиака над поверхностью катализатора:
Физические свойства. Химические свойства. 1. Основные свойства. Будучи
что приводит к усилению основных свойств. Напротив, фенильный радикал C6H5— проявляет отрицательный мезомерный (-М) эффект и уменьшает электронную плотность на атоме азота:
Щелочная реакция растворов аминов объясняется образованием гидроксильных ионов при взаимодействии аминов с водой:
Амины в чистом виде или в растворах взаимодействуют с кислотами, образуя соли:
Обычно соли аминов — твердые вещества без
2. Горение. Амины сгорают в кислороде, образуя азот, углекислый газ и воду:
3. Реакции с азотистой кислотой. а) Первичные алифатические амины при действии азотистой кислоты превращаются в спирты:
б) Первичные ароматические амины при действии HNO2 превращаются в соли диазония:
в) Вторичные амины (алифатические и ароматические) дают нитрозосоединения — вещества с характерным запахом:
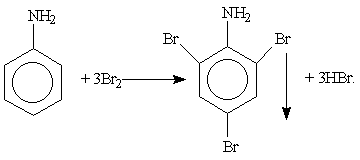
Важнейшие представители аминов. Простейшие алифатические амины — метиламин, диметиламин, диэтиламин — находят применение при синтезе лекарственных веществ и других продуктов органического синтеза. Гексаметилендиамин NH2—(СН2)2—NH6 является одним из исходных веществ для получения важного полимерного материала нейлона. Анилин C6H5NH2 — важнейший из ароматических аминов. Он представляет собой бесцветную маслянистую жидкость, мало растворимую в воде. Для качественного обнаружения анилина используют его реакцию с бромной водой, в результате которой выпадает белый осадок 2,4,6-триброманилина:
Анилин применяется для получения красителей, лекарственных препаратов, пластмасс и т. д. Аминокислоты. Аминокислоты — это органические бифункциональные соединения, в состав которых входят карбоксильная группа —СООН и аминогруппа —NH2. В зависимости от взаимного расположения обеих функциональных групп различают a -, b -, g -аминокислоты и т. д.:
Греческая буква при атоме углерода обозначает его удаленность от карбоксильной группы. Обычно рассматривают только a -аминокислоты, поскольку другие аминокислоты в природе не встречаются. В состав белков входят 20 основных аминокислот (см. табл.). Важнейшие a -аминокислоты общей формулы
Все природные аминокислоты можно разделить на следующие основные группы: 1) алифатические предельные аминокислоты (глицин, аланин); 2) серосодержащие аминокислоты (цистеин); 3) аминокислоты с алифатической гидроксильной группой (серин); 4) ароматические аминокислоты (фенилаланин, тирозин); 5) аминокислоты с кислотным радикалом (глутаминовая кислота); 6) аминокислоты с основным радикалом (лизин). Изомерия. Во всех a -аминокислотах, кроме глицина, a Получение. 1. Гидролиз белковых веществ 2. Замещение галогена на аминогруппу
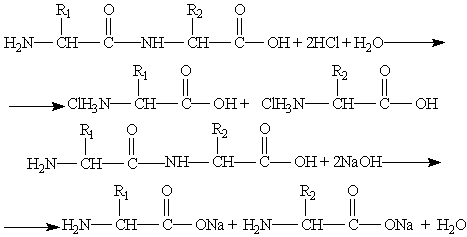
Физические свойства. Аминокислоты представляют собой Химические свойства. Аминокислоты — это органические амфотерные соединения.
При растворении аминокислот в воде карбоксильная группа отщепляет ион водорода, который может
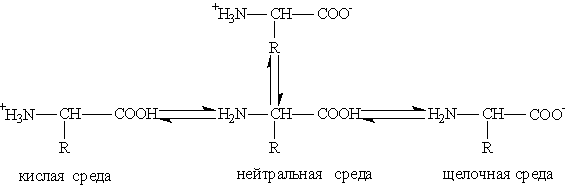
Кислотно-основные превращения аминокислот в различных средах можно изобразить следующей схемой:
Водные растворы аминокислот имеют нейтральную, щелочную или кислую среду в зависимости от количества Аминокислоты могут реагировать со спиртами в присутствии газообразного хлороводорода, превращаясь в сложный эфир:
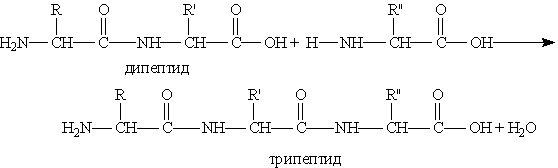
Важнейшее свойство аминокислот — их способность к конденсации с образованием пептидов. Пептиды. Пептиды. — это продукты конденсации двух или более молекул аминокислот.
Полученное соединение называют дипептидом. Молекула дипептида, подобно аминокислотам, содержит
Продукт реакции называется трипептидом. Процесс наращивания пептидной Основное свойство пептидов — способность к гидролизу. Гидролиз пептидов может происходить в
Ферментативный гидролиз важен тем, что протекает селективно, т. е. позволяет расщеплять строго определенные участки пептидной цепи. Качественные реакции на аминокислоты. 1) Все аминокислоты окисляются нингидрином Белки. Белки — это природные полипептиды с высокими значениями молекулярной массы (от 10 000 до десятков миллионов). Они входят в состав всех живых организмов и выполняют разнообразные биологические функции. Строение. Можно выделить четыре уровня в строении полипептидной цепи. Первичная структура белка — это конкретная последовательность аминокислот в полипептидной цепи. Вторичная структура — это конформация полипептидной цепи, т. е. способ Третичная структура белка — это трехмерная конфигурация закрученной спирали в пространстве. Третичная структура — высшая форма пространственной организации белков. Однако некоторые белки (например, гемоглобин) имеют четвертичную структуру, которая образуется за счет взаимодействия между разными полипептидными цепями. Физические свойства белков весьма разнообразны и определяются их строением. По физическим свойствам белки делят на два класса: глобулярные белки растворяются в воде или образуют коллоидные растворы, фибриллярные белки в воде нерастворимы. Химические свойства. 1. Разрушение вторичной и третичной структуры белка с сохранением первичной структуры называют денатурацией. 2. Гидролиз белков — это необратимое разрушение первичной структуры в кислом или щелочном растворе с образованием аминокислот. Анализируя продукты гидролиза, можно установить количественный состав белков. 3. Для белков известно несколько качественных реакций. Биологическое значение белков: 1. Абсолютно все химические реакции в организме протекают в присутствии катализаторов — ферментов. Все 2. Некоторые белки выполняют транспортные функции и переносят молекулы или 3. Белки — это строительный материал клеток. Из них построены опорные, мышечные, покровные ткани. 4. Белки играют важную роль в иммунной системе организма. Существуют специфические белки (антитела), которые способны распознавать и связывать чужеродные объекты — вирусы, бактерии, чужие клетки. 5. Белки-рецепторы воспринимают и передают сигналы, поступающие от Из приведенного перечня функций белков ясно, что белки жизненно | |||||||||||||||||||
| ნანახია: 589 | | |||||||||||||||||||
| სულ კომენტარები: 0 | |
სექციის კატეგორიები | |||||
|---|---|---|---|---|---|
|
შესვლის ფორმა |
|---|
ძებნა |
|---|
მინი-ჩეთი |
|---|
საიტის მეგობრები |
|---|
სტატისტიკა |
|---|