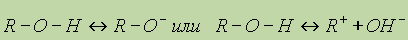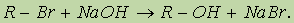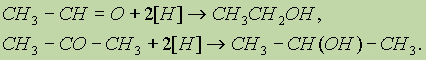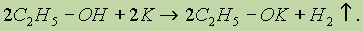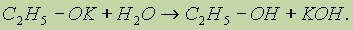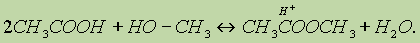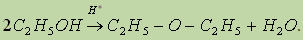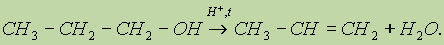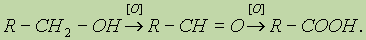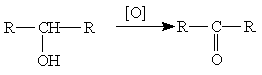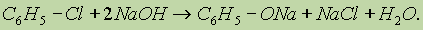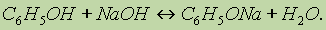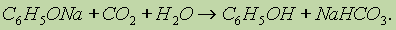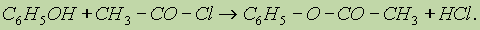აბაშის ხმა
Каталог статей
| მთავარი » სტატიები » Химия » Органическая химия |
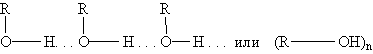
Спирты. Фенолы. Простые эфирыСпирты. Спиртами называют соединения, содержащие одну или несколько гидроксильных групп, непосредственно связанных с углеводородным радикалом. В зависимости от характера углеводородного радикала спирты делятся на алифатические, алициклические и ароматические, причем у последних гидроксильная группа не связана с атомом углерода бензольного кольца. Спирты, у которых гидроксильная группа связана с ароматическим кольцом, называются фенолами. В зависимости от числа гидроксильных групп спирты подразделяют на одно-, двух- и трехатомные. Двухатомные спирты часто называют гликолями. Спирты, содержащие несколько групп —ОН, объединяют общим названием многоатомные спирты. В зависимости от того, при каком углеродном атоме находится гидроксильная группа, различают спирты первичные (RСН2ОН), вторичные (R2СНОН) и третичные (R3СОН). Спирты Структурная изомерия предельных спиртов определяется строением углеродной цепи и положением гидроксильной группы в цепи. Изомерия двух и трехатомных спиртов, кроме того, определяется взаимным расположением гидроксильных групп. По систематической номенклатуре названия спиртов образуют, добавляя суффикс -ол к названию углеводорода с самой длинной углеродной цепью, включающей гидроксильную группу. Нумерацию цепи начинают с того края, ближе к которому расположена гидроксильная группа. Физические свойства спиртов зависят от строения углеводородного радикала, количества гидроксильных групп и их положения. Первые представители гомологического ряда спиртов — жидкости, высшие — твердые вещества. Метанол и этанол смешиваются с водой в любых соотношениях. С ростом молекулярной массы растворимость спиртов в воде падает. Высшие спирты практически нерастворимы в воде. Спирты обладают аномально высокими температурами кипения по сравнению с углеводородами, что объясняется сильной ассоциацией молекул спирта в жидком состоянии за счет образования достаточно прочных водородных связей:
Этим объясняется то, что уже первые члены гомологического ряда спиртов — жидкости, которые имеют сравнительно высокие температуры кипения. Образованием водородных связей между молекулами спирта и воды объясняется их хорошая растворимость в воде. Уменьшение же растворимости у последующих членов гомологического ряда вызывается увеличением числа атомов углерода в углеводородном радикале. Водородные связи — непрочные (17-22 кДж/моль) и при испарении спиртов легко разрываются. Химические свойства спиртов обусловлены наличием в их молекулах полярных ковалентных связей С—О и О—Н. Спирты вступают в химические реакции с разрывом одной из этих связей. Так как обе связи полярны, то их разрыв происходит по ионному (гетеролитическому) механизму с образованием органических анионов или катионов:
Диссоциация спиртов на ионы происходит в незначительной степени, поэтому спирты дают нейтральную реакцию — в их присутствии не изменяется окраска лакмуса или фенолфталеина. Способы получения. 1. Получение из алкенов. Гидратация алкенов протекает по механизму электрофильного присоединения по правилу Марковникова. Это один из наиболее важных промышленных способов получения спиртов. 2. Получение из галогенопроизводных. Галогеналканы гидролизуются под действием водных растворов щелочей. Реакция протекает по механизму нуклеофильного замещения:
3. Восстановление карбонильных соединений. При восстановлении альдегидов образуются первичные спирты, при восстановлении кетонов — вторичные:
4. Действие реактивов Гринъяра на карбонильные соединения. Химические свойства. Различают два основных типа реакций спиртов с участием функциональной группы —ОН:
а) взаимодействие спиртов с щелочными и щелочноземельными металлами с образованием алкоксидов; б) реакция спиртов с органическими и минеральными кислотами с образованием сложных эфиров; в) окисление спиртов под действием дихромата или перманганата калия до карбонильных соединений. Скорость реакций, при которых разрывается связь О—Н, уменьшается в ряду: первичные спирты > вторичные > третичные. а) каталитическая дегидратация с образованием алкенов (внутримолекулярная дегидратация) или простых эфиров (межмолекулярная дегидратация); б) замещение группы —ОН галогеном, например при действии галогеноводородов с образованием алкилгалогенидов. Скорость реакций, при которых разрывается связь С—О, уменьшается в ряду: третичные спирты > вторичные > первичные. Спирты являются амфотерными соединениями. 1. Кислотные свойства спиртов выражены очень слабо. Низшие спирты бурно реагируют с щелочными металлами:
С увеличением длины углеводородного радикала скорость этой реакции замедляется. В присутствии следов влаги образующиеся алкоголяты разлагаются до исходных спиртов:
Это доказывает, что спирты — более слабые кислоты, чем вода. 2. Слабые основные свойства спиртов обусловлены наличием неподеленной электронной пары на атоме кислорода и проявляются в обратимых реакциях с галогеноводородами:
Положение равновесия зависит от соотношения реагентов. 3. Образование сложных эфиров протекает по механизму нуклеофильного присоединения-отщепления:
В качестве нуклеофила выступает молекула спирта, атакующая атом углерода карбоксильной группы, несущий частичный положительный заряд. Отличительной особенностью этой реакции является то, что замещение протекает у атома углерода, находящегося в состоянии sp2-гибридизации. 4. Межмолекулярная дегидратация спиртов. При нагревании спирта в присутствии каталитических количеств сильной кислоты происходит отщепление молекулы воды от двух молекул спирта и образуется простой эфир:
Простые эфиры — это органические вещества, молекулы которых состоят из углеводородных радикалов, соединенных атомом кислорода: R'—О—R", где R' и R" — радикалы, которые могут быть различными или одинаковыми. Диэтиловый, или серный, эфир — хороший растворитель многих органических веществ, применяется для чистки тканей, а в медицине — при хирургических операциях, так как обладает анестезирующим действием. 5. Реакция элиминирования, или внутримолекулярной дегидратации (см. "Алкены”). Конкурентная реакции 4) (см. предыдущую реакцию), реакция 5) становится преобладающей при использовании больших количеств кислоты:
6. Реакции окисления. Первичные спирты окисляются в альдегиды, которые, в свою очередь, могут окисляться в карбоновые кислоты:
Вторичные спирты окисляются в кетоны:
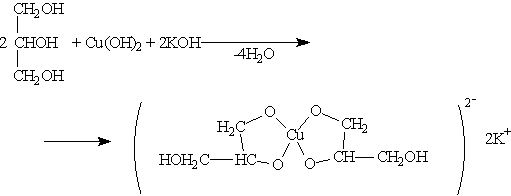
Третичные спирты более устойчивы к окислению. При действии на них сильных окислителей может происходить расщепление углеродного скелета молекулы третичного спирта с образованием карбоновых кислот и кетонов с меньшим числом углеродных атомов, чем в молекуле исходного третичного спирта. Окисление обычно проводят дихроматом или перманганатом калия с серной кислотой. Многоатомные спирты. Двух- и трехатомные спирты получают теми же способами, что и одноатомные. В качестве исходных соединений могут быть использованы алкены, галогенопроизводные и другие соединения. Общим методом синтеза гликолей является окисление алкенов перманганатом калия в нейтральной или щелочной среде. Для двух- и трехатомных спиртов характерны основные реакции одноатомных спиртов. Однако в их химических свойствах есть особенности, обусловленные присутствием в молекуле двух и более гидроксильных групп. Кислотность многоатомных спиртов выше, чем одноатомных, что объясняется наличием в молекуле дополнительных гидроксильных групп, обладающих отрицательным индуктивным эффектом. Поэтому многоатомные спирты, в отличие от одноатомных, реагируют с щелочами, образуя соли. По аналогии с алкоголятами соли двухатомных спиртов называют гликолятами, а трехатомных — глицератами. При взаимодействии гидроксида меди (II) с глицерином и другими многоатомными спиртами происходит растворение гидроксида и образуется комплексное соединение синего цвета. Эта реакция используется для обнаружения многоатомных спиртов, имеющих гидроксильные группы при соседних атомах углерода —СН(ОН)—СН(ОН)—:
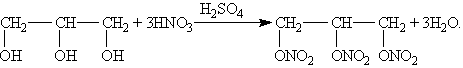
Для многоатомных спиртов характерно образование сложных эфиров. В частности, при реакции глицерина с азотной кислотой в присутствии каталитических количеств серной кислоты образуется тринитрат глицерина (нитроглицерин):
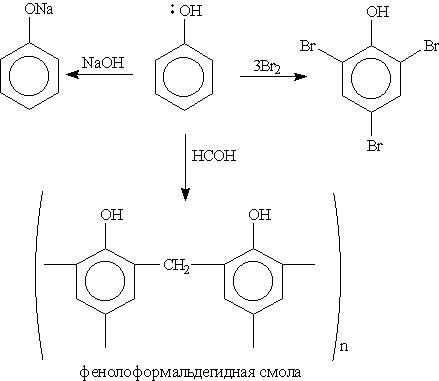
Фенолы. Названия фенолов составляют с учетом того, что для родоначальной структуры по правилам ИЮПАК сохранено тривиальное название "фенол”. Нумерацию атомов углерода бензольного кольца начинают от атома, непосредственно связанного с гидроксильной группой (если она является старшей функцией), и продолжают в такой последовательности, чтобы имеющиеся заместители получили наименьшие номера. Монозамещенные производные фенола, например метилфенол (крезол), могут существовать в виде трех структурных изомеров — орто-, мета- и пара-крезолов. Физические свойства. Фенолы в большинстве своем — кристаллические вещества (мета-крезол — жидкость) при комнатной температуре. Они обладают характерным запахом, довольно плохо растворимы в воде, но хорошо растворяются в водных растворах щелочей. Фенолы образуют прочные водородные связи и имеют довольно высокие температуры кипения. Способы получения. 1. Получение из галогенбензолов. При нагревании хлорбензола и гидроксида натрия под давлением получают фенолят натрия, при дальнейшей обработке которого кислотой образуется фенол:
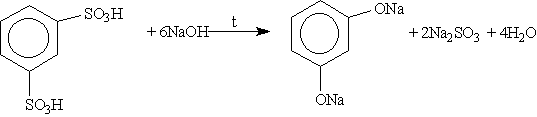
2. Получение из ароматических сульфокислот (см. реакцию 3 в разделе "Химические свойства бензола”), реакция проводится при сплавлении сульфокислот со щелочами. Первоначально образующиеся феноксиды обрабатывают сильными кислотами для получения свободных фенолов. Метод обычно применяют для получения многоатомных фенолов:
Химические свойства. В фенолах р-орбиталь атома кислорода образует с ароматическим кольцом единую p -систему. Вследствие такого взаимодействия электронная плотность у атома кислорода уменьшается, а в бензольном кольце повышается. Полярность связи О—Н увеличивается, и водород ОН-группы становится более реакционноспособным и легко замещается на металл даже при действии щелочей (в отличие от предельных одноатомных спиртов). Кроме того, в результате такого взаимного влияния в молекуле фенола увеличивается реакционная способность бензольного кольца в орто- и пара-положениях в реакциях электрофильного замещения (галогенирования, нитрования, поликонденсапии и т. д.):
1. Кислотные свойства фенола проявляются в реакциях со щелочами (сохранилось старинное название "карболовая кислота”):
Фенол, однако, является очень слабой кислотой. При пропускании через раствор фенолятов углекислого или сернистого газов выделяется фенол — такая реакция доказывает, что фенол — более слабая кислота, чем угольная и сернистая:
Кислотные свойства фенолов ослабляются при введении в кольцо заместителей I рода и усиливаются при введении заместителей II рода. 2. Образование сложных эфиров. В отличие от спиртов фонолы не образуют сложных эфиров при действии на них карбоновых кислот; для этого используются хлорангидриды кислот:
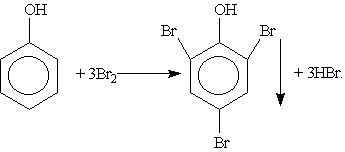
3. Галогенирование. При действии на фенол бромной воды образуется осадок 2,4,6-трибромфенола:
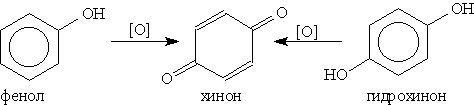
Это — качественная реакция для обнаружения фенола. 4. Нитрование. Под действием 20% -ной азотной кислоты фенол легко превращается в смесь орто- и пара-нитрофенолов. Если нитровать фенол концентрированной азотной кислотой, то образуется 2,4,6-тринитрофенол — сильная кислота (пикриновая). 5. Окисление. Фенолы легко окисляются даже под действием кислорода воздуха. Так, при стоянии на воздухе фенол постепенно окрашивается в розовато-красный цвет. При энергичном окислении фенола хромовой смесью основным продуктом окисления является хинон. Двухатомные фенолы окисляются еще легче. При окислении гидрохинона образуется хинон:
| |
| ნანახია: 489 | |
| სულ კომენტარები: 0 | |
სექციის კატეგორიები | |||||
|---|---|---|---|---|---|
|
შესვლის ფორმა |
|---|
ძებნა |
|---|
მინი-ჩეთი |
|---|
საიტის მეგობრები |
|---|
სტატისტიკა |
|---|